UNA PROPUESTA PARA COMPRENDER LOS EFECTOS DE LOS METALES PESADOS EN MAMÍFEROS

M.I.Q. Teresa de Jesus Larios Pachuca
Candidata al Doctorado en Ciencias del Agua
teresa.lariospa@udlap.mx
Actualmente, se estima que más de un millón de sustancias diferentes se introducen en las aguas naturales a través de vertidos antropogénicos. Muchas de estas sustancias pueden no considerarse tóxicas, pero pueden alterar las características organolépticas del agua como el sabor, color y olor así como alterar gravemente el ecosistema y/o ser directamente perjudiciales para los seres humanos [1].
De acuerdo con Pabón et al.[2], los metales pesados son elementos químicos con alta densidad (mayor a 4 g/cm3), masa y peso atómico superior a 20 en la tabla periódica, y son tóxicos incluso en bajas concentraciones. Algunos de estos elementos incluyen Aluminio (Al), Berilio (Be), Cobre (Cu), Hierro (Fe), Manganeso (Mn), Cadmio (Cd), Mercurio (Hg), Plomo (Pb), entre otros [3]. Actualmente, uno de los principales problemas ambientales es la contaminación de las fuentes de agua del mundo por metales pesados, ya que la toxicidad de estos compuestos en el agua se considera un problema grave para los habitantes de las comunidades que dependen de dicho recurso. Se entiende por toxicología, a la rama de la ciencia que se ocupa del estudio de los venenos o tóxicos. Un veneno o tóxico es toda radiación física o agente químico que, tras generarse internamente o entrar en contacto, penetrar o ser absorbido por un organismo vivo, en dosis suficientemente alta, puede producir un efecto adverso directo o indirecto en el mismo [4]. A diferencia de muchos contaminantes orgánicos, los metales pesados generalmente no se eliminan de los ecosistemas acuáticos mediante procesos naturales porque no son biodegradables [5]. Por el contrario, son altamente contaminantes y experimentan un ciclo eco biológico o medioambiental, es decir es el proceso natural por el que los elementos circulan de forma continua entre los seres vivos, el agua, el aire y el suelo, siendo las aguas naturales la vía principal de transporte. Hoy en día, los metales pesados tienen gran importancia como indicadores de la calidad ambiental de cualquier flujo de agua debido a su toxicidad y particularmente a su comportamiento bio acumulativo [6] y alcanzan concentraciones progresivamente más altas a medida que ascienden los niveles tróficos, lo que representa un riesgo para la salud de las personas que los consumen [7].

Los metales pesados se liberan al medio ambiente, principalmente a través de la erosión natural de las rocas y la actividad volcánica, así como de actividades humanas como la agricultura, la minería y la industria [8]. Las principales vías de transporte de los metales pesados a través de la atmósfera y el agua son los procesos de dispersión y deposición que conducen a la acumulación en el suelo y los sedimentos del agua, ocasionando que se conviertan en reservorios secundarios de energía seminaturales [9]. La continua acumulación y migración de metales pesados en los sedimentos no sólo supone una grave amenaza para los organismos acuáticos y el riego de tierras agrícolas, sino que también pone en peligro la salud humana a través del agua potable y las cadenas alimentarias [10]. Se ha demostrado que el consumo de aguas subterráneas contaminadas con metales pesados en zonas donde se utiliza agua para riego de cultivos, el contacto directo con suelos regados por este recurso y el consumo de productos derivados de la misma fuente representan un grave riesgo para el ser humano, debido a la posible aparición de enfermedades cancerosas y no cancerosas [11].

Los metales pesados son las principales toxinas acuáticas, haciendo que la preocupación por la contaminación de estos compuestos en el agua haya aumentado en los últimos años [9]. Ya que su toxicidad depende no sólo de su concentración total, ruta y frecuencia de exposición, sino también de su disponibilidad y reactividad con otros componentes del sistema [12].
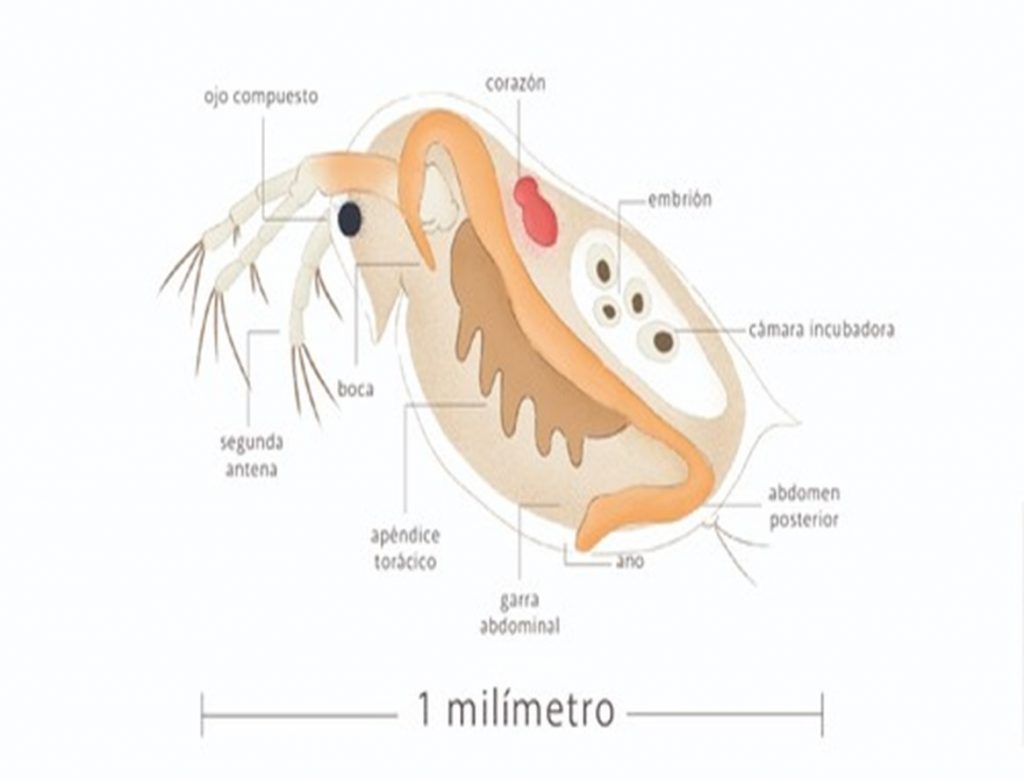
De tal forma que la prevención y, más aún, la corrección de los efectos negativos de la contaminación tiene un costo muy elevado. Países como Estados Unidos, Japón, algunas naciones integrantes de la Unión Europea y recientemente México en el 2021 han incorporado a su legislación de Control de Calidad del Ambiente criterios que surgen de bioensayos. Un bioensayo consiste en medir la toxicidad de alguna sustancia o de efluentes, sometiendo deliberadamente a algún ser vivo a distintas concentraciones [13]. En este sentido la especie Daphnia magna es una de las más utilizadas en el mundo, por su sensibilidad y eficacia, y ha sido adoptada por diferentes instituciones encargadas de las normas de control del medio ambiente, con el objetivo de comprender si los mecanismos de acción y efectos que presentan los contaminantes sobre la especie D. magna pueden ser comparados con los manifestados en animales superiores.Este organismo Daphnia magna es un crustáceo macroscópico que alcanza los 5 o 6 mm en etapa adulta. Este pequeño crustáceo además, posee diversas propiedades que lo hacen atractivo para la investigación. Entre ellas, los bajos costos de equipamiento y mantenimiento, la alta tasa de reproducción mediada por partenogénesis (reproducción sin intervenciones del macho) y la poca variabilidad genética. En el laboratorio los investigadores sacamos provecho al método de reproducción de las daphnias para crear un ejército de ellas, esto es muy importante porque cada organismo es exactamente el mismo y con esto aseguramos que su reacción será igual en cualquier experimento que desarrollemos. Las poblaciones ordinariamente están constituidas íntegramente de hembras. Los huevos se depositan y desarrollan dentro de la cámara incubadora; de aquí las crías se liberan como versiones en miniatura de los adultos. El número de individuos por camada varía entre 1 y 300 y depende del tamaño del espécimen y de la alimentación de este [14].

Mamá Daphnia y su ejército

Este proceso de reproducción por parte de la Daphnia es diario, alrededor de su tiempo de vida de 2 meses puede tener más de mil clones. ¿Puedes creerlo? ¡vive para reproducirse¡ Esta habilidad nos ayuda a identificar cómo se ve amenazada su reproducción si están expuestas a diferentes tipos de contaminantes como metales pesados. Así si un químico entra al agua dulce y disminuyen la cantidad de los crustáceos, se puede inferir que el compuesto tóxico afecta su reproducción y a su vez a los animales que se alimentan de ellas. Estos pequeños crustáceos se alimentan principalmente de fitoplancton, bacterias, así como materia orgánica particulada o disuelta y de alga espirulina en el laboratorio. Para esto ellas utilizan sus apéndices corporales que son como sus brazos para desplazarse asi mismo, son filtradores no selectivos de partículas, lo que permite mejorar las condiciones del agua al reducir la concentración de sólidos en suspensión [15].
Pero entre tantas características, destaca una difícilmente encontrada en el reino animal: traslucidez. Así, mediante microscopía óptica se pueden vislumbrar sus órganos vitales tales como el sistema digestivo y sistema circulatorio. Daphnia magna posee uno de los corazones más pequeños del reino animal, y quizá su ritmicidad compita por ser una de las más altas (con una frecuencia promedio de 210 latidos por minuto) [13], esta peculiaridad nos permite evaluar sus parámetros fisiológicos como frecuencia cardiaca, movimiento torácico, así como su comportamiento natatorio.
La distribución geográfica, su importante papel en la comunidad zooplántica, su facilidad de cultivo y su anatomía transparente hacen de la Daphnia magna un medio ideal como biomodelo para investigaciones biológicas asociadas a la ecología, evolución y biología reproductiva, pero sobre todo en la ecotoxicología. Además, debido a que es un organismo sensible ante la presencia de factores y cambios ambientales, se emplea para determinar toxicidad aguda y toxicidad crónica mediante la evaluación de biomarcadores en respuesta a diversos estresores químicos o físicos [16].
Así que si un día sales a caminar y te encuentras en cualquier cuerpo de agua estos crustáceos evita agredirlos, y no los intestes atrapar ya que nos ayudan a entender mejor como los químicos interactúan con los organismos y el medio ambiente.
Referencias
[1] H. Rosas, “Estudio de la contaminación por metales pesados en la cuenca del Llobregat,” Universitat Politècnica de Catalunya. Departament d’Enginyeria Minera i Recursos Naturals, Catalunya, 2001.
[2] Pabón S.E, R. Benítez, Sarria A., and J. A. Gallo, “Contaminación del agua por metales pesados, métodos de análisis y tecnologías de remoción. Una revisión.,” Entre Ciencia e Ingeniería, vol. 14, no. 27, pp. 9–18, 2020.
[3] L. F. Londoño Franco, P. T. Londoño Muñoz, and F. G. Muñoz Garcia, “Los riesgos de los metales pesados en la salud humana y animal,” Biotecnoloía en el Sector Agropecuario y Agroindustrial, vol. 14, no. 2, p. 145, 2016, doi: 10.18684/bsaa(14)145-153.
[4] E. R. Reyes, Introducción a la toxicología. 2016.
[5] U. Förstner and F. Prosi, “Heavy Metal Pollution in Freshwater Ecosystems,” Biological Aspects of Freshwater Pollution, pp. 129–161, 1979, doi: 10.1016/b978-0-08-023442-7.50011-6.
[6] S. M. N. Moalla, R. M. Awadallah, M. N. Rashed, and M. E. Soltan, “Distribution and chemical fractionation of some heavy metals in bottom sediments of Lake Nasser,” 1998.
[7] Y. G. Pérez Cruz, L. J. Rangel Ruiz, and J. Gamboa Aguilar, “Metales en almejas y sedimentos en la Reserva de la Biósfera ‘Pantanos de Centla’ Tabasco, México,” Hidrobiológica, vol. 23, no. 1, pp. 1–8, 2013.
[8] T. E. Romanova, O. v. Shuvaeva, and L. a. Belchenko, “Phytoextraction of trace elements by water hyacinth in contaminated area of gold mine tailing,” Int J Phytoremediation, vol. 18, no. 2, pp. 190–194, Feb. 2016, doi: 10.1080/15226514.2015.1073674.
[9] A. Elzwayie, H. A. Afan, M. F. Allawi, and A. El-Shafie, “Heavy metal monitoring, analysis and prediction in lakes and rivers: state of the art,” Environmental Science and Pollution Research, vol. 24, no. 13, pp. 12104–12117, 2017, doi: 10.1007/s11356-017-8715-0.
[10] Z. Zhang et al., “Relationships between soil properties and the accumulation of heavy metals in different Brassica campestris L. growth stages in a Karst mountainous area,” Ecotoxicol Environ Saf, vol. 206, no. August, p. 111150, 2020, doi: 10.1016/j.ecoenv.2020.111150.
[11] A. Mora, M. García-Gamboa, M. S. Sánchez-Luna, L. Gloria-García, P. Cervantes-Avilés, and J. Mahlknecht, “A review of the current environmental status and human health implications of one of the most polluted rivers of Mexico: The Atoyac River, Puebla,” Aug. 15, 2021, Elsevier B.V. doi: 10.1016/j.scitotenv.2021.146788.
[12] J. G. Cabezas, J. Alonso, J. Pastor, and I. Sastre-Conde, “Absorción y acumulación de metales pesados en tres especies vegetales en suelos enmendados con lodos de depuradora.,” Environmental Biotechnology and Engineering, 2004.
[13] Instituto Mexicano de Tecnología del Agua, “El IMTA realiza investigación de eco toxicología utilizando Daphnia Magna.”
[14] íNaturalistMX, “Pulga de Agua.”
[15] Č. Stevčić, K. Pulkkinen, and J. Pirhonen, “Efficiency of Daphnia magna in removal of green microalgae cultivated in Nordic recirculating aquaculture system wastewater,” Algal Res, vol. 52, Dec. 2020, doi: 10.1016/j.algal.2020.102108.
[16] B. Y. Lee et al., “The genome of the freshwater water flea Daphnia magna: A potential use for freshwater molecular ecotoxicology,” Aquatic Toxicology, vol. 210, pp. 69–84, May 2019, doi: 10.1016/j.aquatox.2019.02.009.
[17] S. Yuan, C. Liang, W. Li, R. J. Letcher, and C. Liu, “A comprehensive system for detection of behavioral change of D. magna exposed to various chemicals,” J Hazard Mater, vol. 402, Jan. 2021, doi: 10.1016/j.jhazmat.2020.123731.
